כפי ש שחרור אינסולין או הפרשת אינסולין היא הפרשת ההורמון החיוני אינסולין על ידי הלבלב (הלבלב).
מהו שחרור האינסולין?

האינסולין מיוצר רק בתאי הבטא של איים Langerhans שנמצאים בלבלב, וממנו נגזר שמו. שחרור האינסולין מגורר על ידי תכולת גלוקוז מוגברת, ובמידה פחותה, על ידי חומצות שומן חופשיות וכמה חומצות אמינו, וכן על ידי הורמונים במערכת העיכול.
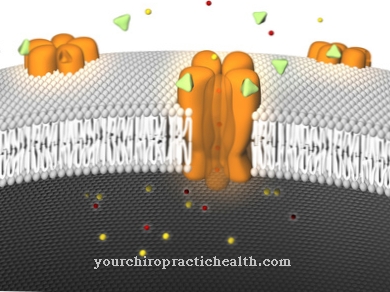
ההדק גורם להיווצרות של יותר אדנוזין טריפוספט (ATP) בתאי הבטא, מה שמוביל לחסימה של תעלות תלויות אשלגן. זה מאפשר ליוני סידן מהחלל החוץ תאי לחדור טוב יותר לתאי הבטא ולהפעיל את שחרור האינסולין.
שלפוחית אינסולין מתמזגת אז עם קרום התא של תא הבטא ומתרוקנת לחלל החוץ תאי (תהליך של אקסוציטוזיס). האינסולין מתחיל להשתחרר.
האינסולין לא משתחרר באופן שווה, אלא בשפיות. תאי הבטא משחררים אינסולין לדם בערך כל 3 עד 6 דקות.
פונקציה ומשימה
האינסולין מבטיח שתאי הגוף יספגו גלוקוז מהדם להמרת אנרגיה. בתפקוד זה כקשר בין סוכר לתאים, האינסולין מבטיח שרמת הסוכר בדם נשארת בטווח הרגיל ואינו עולה.
זהו ההורמון היחיד שמסוגל להוריד את רמות הסוכר בדם. מקבילו, גלוקגון, ובמתינות, קורטיזול, אדרנלין והורמוני בלוטת התריס, מגבירים את אחוז הסוכר בדם.
כאשר הגוף אוכל מזונות עשירים בפחמימות, הוא ממיר אותם לסוכר, מה שמעלה את רמות הסוכר בדם. בתגובה לכך, תאי הבטא משחררים יותר אינסולין. זה עוזר לגלוקוזה מהדם לעבור דרך דפנות התא אל פנים התא, ואז מופחת תכולת הגלוקוזה בפלסמת הדם. לאחר מכן, הגלוקוז מאוחסן בתאי הגוף כגליקוגן או הופך אותו מייד לאנרגיה.
הגליקוגן מוחזק בתא עד שיש צורך חריף באנרגיה. ואז הגוף נופל לאחור על מאגרי הגליקוגן וממיר אותם לאנרגיה שהוא זקוק להם.
הצעד המרכזי בהמרה זו, המכונה גליקוליזה, מתרחש בעשרה צעדים בודדים. במהלך זה, הגלוקוזה מפוצל לחומצה לקטית ואתנול בעזרת נוקלאוטיד אדנוזין טריפוספט ומוכן למרה נוספת של אנרגיה.
תאי הכבד והשריר בפרט יכולים לספוג ולאגור כמויות גדולות של גלוקוז. הם מגיבים טוב במיוחד לפעולה של אינסולין, מכיוון שקרומי התא שלהם הופכים חדירים ונגישים יותר לגלוקוז כאשר יש שחרור מוגבר של אינסולין.
לעומת זאת, תאי עצב תופסים גלוקוז מהדם ללא תלות בשחרור האינסולין. אם התאים התלויים באינסולין נוטלים יותר גלוקוז כאשר רמת האינסולין מוגברת, תאי העצב יכולים לחוות אספקת תת-גלוקוז, מכיוון שבמקרה זה נותר מעט מדי גלוקוז בשבילם. במקרה של היפוגליקמיה חמורה (רמות נמוכות בסוכר בדם) קיים אפוא הסיכון לפגיעה במערכת העצבים התלויה בגלוקוז.
אם רמת הסוכר בדם יורדת לערך של בערך 80 מ"ג לד"ל, המתנגדים הנזכרים לעיל אדרנלין, גלוקגון או קורטיזול משמשים להגברת הסוכר בדם. ייצור האינסולין בגוף מופחת מאוד בתקופה זו.
מחלות ומחלות
סוכרת היא המונח הגנרי להפרעות שונות בטיפול בגוף באינסולין. בסוכרת מסוג 1 הגוף כבר לא מסוגל לייצר אינסולין בעצמו. מערכת החיסון הורסת את תאי הבטא המייצרים אינסולין ומובילה בסופו של דבר למחסור באינסולין.
לאחר מכן הגלוקוז בדם כבר לא יכול להיכנס לתאים והם חסרים כספק אנרגיה. לאחר פרק זמן מסוים, יש חוסר באנרגיה בתאי הגוף, עלייה ברמת הסוכר בדם, אובדן חומרים מזינים ומים וחומצת יתר של הדם.
סוכרת מסוג 1 מטופלת בדרך כלל בתכשירי אינסולין המיוצרים באופן מלאכותי הניתנים תת עורית בצורה של מזרקים או בעזרת משאבת אינסולין. הסיבה המדויקת לסוכרת מסוג 1 טרם הובהרה. כעת מניחים תהליך רב-פקטורלי, בו מעורבים השפעות גנטיות וסביבתיות כאחד.
בסוכרת מסוג 2, הגוף עדיין יכול לייצר את האינסולין עצמו, אך זה יכול להשפיע רק על רקע העמידות לאינסולין בתאים.
סוכרת מסוג 2 מתפתחת לרוב לאורך זמן רב. זה יכול לקחת מספר שנים עד שתושג עמידות מוחלטת לאינסולין ולאבחון בפועל של סוכרת מסוג 2. בתחילה, הגוף יכול לפצות על העיבוד המופחת של האינסולין בתאים על ידי הגברת ייצור האינסולין. עם זאת, ככל שההפרעה נמשכת זמן רב יותר, כך הלבלב יכול להחזיק מעמד בייצור ולא ניתן עוד להסדיר את רמת הסוכר בדם. בסופו של דבר, סוכרת מסוג 2 מתגלה.
סוכרת מסוג 2 אומרת גם שהיא בעלת גורמים רב-פקטורליים. לעומת בניגוד לסוג 1, השמנת יתר היא הטריגר הראשון האפשרי עבורו. לכן סוכרת סוג 2 המתבטאת לאחרונה בדרך כלל מנסה לראשונה לטפל בתזונה. עם זאת, גורמים גנטיים יכולים להיות גם הגורם לסוג 2. במקרה זה, או אם סוכרת מסוג 2 נמשכת לאחר ירידה במשקל, היא מטופלת בטבליות.
מחלה אחרת, אך נדירה בהרבה, הקשורה לאינסולין היא מה שמכונה היפר-אינסולין. כאן מופק יותר מדי אינסולין עקב ייצור יתר של תאי הבטא. תוצאה נמוכה של רמות סוכר נמוכות בדם (היפוגליקמיה).





.jpg)
.jpg)


.jpg)



.jpg)
.jpg)