כחלק מ טיפול גנטי גנים לטיפול במחלות גנטיות מוחדרים לגנום אנושי. ככלל, טיפול בגנים משמש למחלות בולטות כמו SCID או גרנולומטוזיס ספיגה, שלא ניתן לשלוט בהן על ידי גישות טיפוליות מקובלות.
מהו טיפול גנטי?

כפי ש טיפול גנטי הוא המונח המשמש לתיאור החדרת גנים או קטעי גנום לתאים אנושיים. מטרתו לפצות על פגם גנטי לטיפול במחלות תורשתיות.
באופן כללי ניתן להבחין בין טיפול גנטי סומטי לטיפול בגרון. בטיפול גנטי סומטי משתנים תאי הגוף באופן שרק החומר הגנטי של תאי רקמת הגוף שיש לטפל בהם שונה. המידע הגנטי שהשתנה אינו מועבר לדור הבא.
בהקשר של טיפול בגרעין, האסור כמעט בכל המדינות, חל שינוי במידע הגנטי בתאי קו הגיד. בנוסף, בהתאם לאסטרטגיה הטיפולית, מבדילים בין טיפול בתחליפי (החלפת מקטעי גנום פגומים), טיפול בתוספת (חיזוק תפקודי גן ספציפיים כמו הגנה חיסונית בסרטן או מחלות זיהומיות) וטיפול בדיכוי (הפעלה של פעילויות גנים פתוגניים).
מכיוון שניתן להכניס את רצף הגנים לצמיתות או זמנית לתא המטרה, השפעת הטיפול בגנים יכולה להיות קבועה או זמנית גם כן.
פונקציה, אפקט ומטרות
בדרך כלל אחד מכוון טיפול גנטי על ידי החלפת הפגמים בגן שלם, תא המטרה מסוגל לסנתז חומרים החיוניים לאורגניזם (כולל חלבונים, אנזימים).
החלפת החומר הגנטי יכולה להתבצע מחוץ לגוף (ex vivo). למטרה זו, התאים שיש בהם הפגם שיש לטפל בו מוסרים מהאדם הפגוע ומצוידים בגן שלם. לאחר מכן מוחזרים התאים שהשתנו לאדם הפגוע. ניתן להבטיח את הובלת הגנים לתא בשיטות שונות.
במה שמכונה transfection כימי, חיבור חשמלי משפיע על קרום התא כך שהגן הטיפולי יכול להיכנס לתא. החומר הגנטי שהשתנה יכול להיכנס פיזית לתא דרך הזרקת מיקרו או דחף חשמלי הגורם לחלחל באופן זמני לקרום התא (אלקטרופורציה). בנוסף, ניתן לירות במידע שהשתנה אל פנים התא על כדורי זהב קטנים (אקדח חלקיקים).
כחלק מ transfection תוך שימוש ברוחות רפאים אריתרוציטים, אריתרוציטים (כדוריות דם אדומות) מוצגות עם הגנים הטיפוליים בתמיסה. כתוצאה מכך ממברנות התא נפתחות בקצרה ורצף הגנים יכול לחדור. לאחר מכן התמזגו האריתתרוציטים עם תאי המטרה.
בנוסף, ניתן להזריק נגיפים מהונדסים גנטית דרך מה שמכונה התמרה. מכיוון שנגיפים תלויים במטבוליזם של מארח בכדי להתרבות, הם יכולים לפעול כמעבורת גנים כביכול על ידי הברחת החומר הגנטי הבריא החדש לתאי המטרה. DNA, RNA ובמיוחד רטרו-וירוסים משמשים לתהליך ההולכה. תאי יעד מתאימים כוללים תאי כבד, תאי T (לימפוציטים T) ותאי מח עצם.
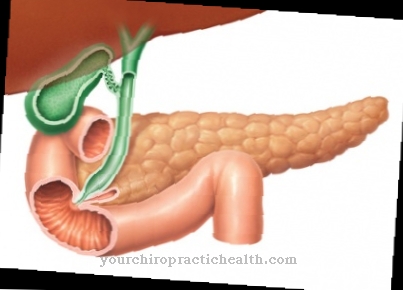
טיפול בגנים משמש בעיקר למחלות קשות של מערכת החיסון כמו SCID (לימפוציטים T פגומים) או גרנולומטוזיס ספיגה (גרנולוציטים נויטרופילים פגומים). זה גם מייצג טיפול אלטרנטיבי אפשרי בגידולים, מחלות זיהומיות חמורות כמו HIV, צהבת B ו- C, שחפת או מלריה, לפיה עדיין נחקרות קליניות האפשרויות הטיפוליות, במיוחד בכל הקשור ל- HIV ושחפת.
התמרה גנטית טיפולית עם רטרו-וירוסים על תאי גזע הדם של הגוף מתאימה במיוחד לבטא-תלסמיה (פגיעה בסינתזת בטא-גלובין).
סיכונים, תופעות לוואי וסכנות
בעוד שמעט מחלות נגרמות כתוצאה מ טיפול גנטי ניתן לטפל, לעומת זאת, לא ניתן להעריך את הסיכונים במלואם במקרים רבים בגלל רמת ההתפתחות הנמוכה של הטיפול.
הסיכון הגדול ביותר בטיפול בגנים טמון בשילוב בלתי מוגדר עד כה של רצף הגנים הטיפולי בתא המטרה. במקרה של שילוב שגוי בגנום של תא המטרה, ניתן לפגוע בתפקוד רצפי הגנים השלמים וניתן להפעיל מחלות קשות אחרות. לדוגמא, ניתן להפעיל פרוטו-אונקוגנים הסמוכים לגן המוחדר, תוך פגיעה בצמיחת תאים תקינה וגורמים לסרטן (מוטגןזה של החדרה).
ניתן היה לראות את אותו הדבר, בין השאר, במחקר בפריס. לאחר ההצלחה הראשונית נמצא כי חלק מהילדים שטופלו בטיפול גנטי חולים בלוקמיה. בנוסף, מערכת החיסון יכולה לסמן את תאי המטרה שהשתנו כזרים ולתקוף אותם (חיסון).
לבסוף, במקרה של הולכה עם וירוסים, קיים סיכון שהאדם המטופל בטיפול גנטי יידבק בסוג פראי של הנגיף המשמש כמעבורת וכי זה יגייס את הרצף שעבר שינוי גנטי מהגנום במידה כזו שהוא יתאים לתואם במקום לא רצוי. יכול לשלב השלכות.









.jpg)
.jpg)