התהליכים הסלולריים והפיזיולוגיים המורכבים ביצורים חיים דורשים ויסות מכוון דק ברמה המולקולרית על מנת להבטיח את יכולת ההסתגלות של חיה או צמח, למשל, לבית הגידול. לצורך זה ישנן מספר רב של מולקולות שמתערבות בתהליכים כמו תקשורת תאים, חילוף חומרים או חלוקת תאים. אחת המולקולות הללו היא חלבון קלמודוליןאשר בעזרת סידן משפיע על תפקודם של הרבה חלבונים פעילים ביולוגיים אחרים.
מה זה קלמודולין?
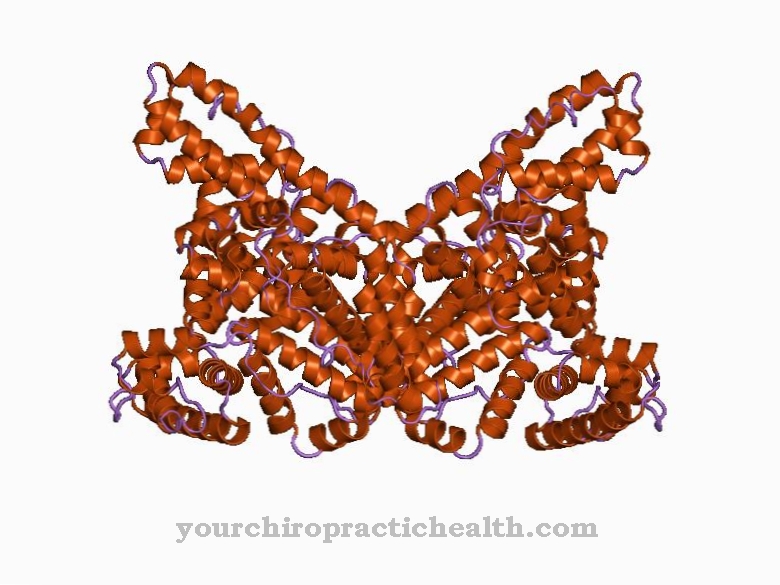
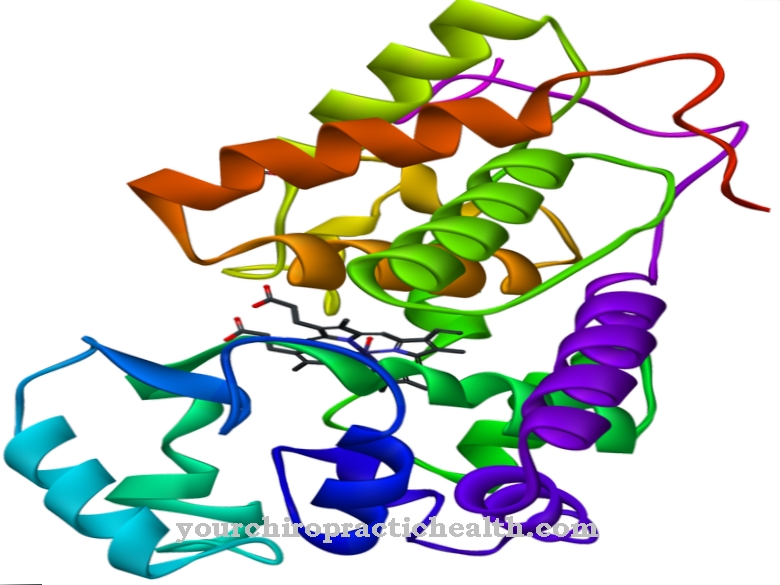
קלמודולין הוא חלבון רגולטורי בין-תאי הקושר בין יוני סידן. בשל מבנהו, הוא שייך לקבוצת חלבוני EF-היד. צורת הקלמודולין, המורכבת מ- 148 חומצות אמינו ואורכה 6.5 ננומטר, דומה למשקולת. המסה המולקולרית של מולקולת חלבון זו היא בערך 17 kDa.
בשל תפקודו הביולוגי בהעברת האות בתוך תאים, קלמודולין יכול גם להיות מסווג כמו שליח שני, כלומר חומר שליח משני, עם זאת, אינו פעיל באופן אנזימטי. בשני התחומים הכדוריים של החלבון ישנם שני מוטיבי סליל-לולאה-הליקס במרחק של 1.1 ננומטר, אליהם ניתן לקשור בסך הכל ארבעה יוני סידן. מבנה זה ידוע כיד EF. מבני ה- EF הידיים מחוברים על ידי קשרי מימן בין יריעות הבטא האנטי-פראלליות של קלמודולין.
פונקציה, אפקט ומשימות
קלמודולין זקוק לשלושה עד ארבעה יוני סידן כבולים לכל מולקולה כדי להיות פעילים. במצב המופעל, מתחם הסידן-קלמודולין שנוצר מעורב בוויסות מספר גדול של קולטנים, אנזימים ותעלות יונים עם מגוון רחב של פונקציות. האנזימים המווסתים כוללים את הפוספטאז קלצינאורין, הממלא תפקיד חשוב בוויסות התגובה החיסונית, וסינתז החנקן האנדותלי (eNOS), המייצר NO, אשר בין היתר משמש להרגעה של שרירים חלקים וכך להרחבת ה כלי דם.
בריכוזי סידן נמוכים מופעל גם אדנילט ציקלאז (AC), בריכוזי סידן גבוהים, לעומת זאת המקביל האנזימטי, פוספודיאסטרז (PDE). באופן זה מושג רצף כרונולוגי של מנגנוני הוויסות: בתחילה ה- AC מגדיר מסלול אות בתנועה באמצעות ייצור AMP מחזורי (cAMP), בהמשך זה מכובה שוב על ידי PDE של היריב באמצעות הפחתת cAMP. עם זאת, ידועה במיוחד ההשפעה הרגולטורית של קלמודולין על קינאזות חלבון כמו CaM kinase II או myosin chain light kinase (MLCK), אשר יוסבר ביתר פירוט בהמשך.
ה- CAMKII יכול לקשור שאריות פוספט לחלבונים שונים ובכך להשפיע על חילוף החומרים האנרגטי, החדירות ליונים ושחרורם של מעבירים עצביים מהתאים. ה- CAMKII נמצא בריכוזים גבוהים במיוחד במוח, שם הוא ממלא תפקיד חשוב בפלסטיות עצבית, כלומר כל תהליכי הלמידה. אבל קלמודולין הוא הכרחי גם לתהליכי תנועה. במנוחה, ריכוז יוני הסידן בתא שריר נמוך מאוד ולכן קלמודולין אינו פעיל. עם זאת, אם תא השריר מתרגש, הסידן זורם לפלסמת התא, וככופקטור, תופס את ארבעת אתרי הכריכה בקלמודולין.
זה יכול כעת להפעיל את kinase שרשרת הקלה מיוזין, המסיטה את הסיבים התכווצים בתא ובכך מאפשרת התכווצות שרירים. אנזימים אחרים, פחות ידועים, הנמצאים תחת השפעת קלמודולין הם גווינלט ציקלאז, Ca-Mg-ATPase ופוספוליפאז A2.
חינוך, התרחשות, תכונות וערכים מיטביים
קלמודולין מופיע בכל האוקריוטות, הכוללות את כל הצמחים, בעלי החיים, הפטריות וקבוצת היצורים האמבוידים. מכיוון שמולקולת הקלמודולין באורגניזמים אלה בדרך כלל בנויה באופן דומה יחסית, ניתן להניח שמדובר בחלבון ישן מאוד מבחינה אבולוציונית שהופיע בשלב מוקדם.
ככלל, קלמודולין קיים בכמויות גדולות יחסית בפלזמה של תא. בציטוזול של תאי עצב, למשל, הריכוז הרגיל הוא סביב 30-50 מיקרומטר, כלומר 0,03-0,05 מול / ל. החלבון נוצר במהלך שעתוק ותרגום באמצעות הגן CALM, אשר ישנם שלושה אללים הידועים עד היום, המכונים CALM-1, CALM-2 ו- CALM-3.
מחלות והפרעות
ישנם כמה כימיקלים שיכולים להשפיע מעכבים על קלמודולין ולכן ידועים כמעכבי קלמודולין. ברוב המקרים, השפעתם המעכבת מתבססת על העובדה שהם מעבירים סידן מהתא וכך מוציאים אותו מהקלמודולין, שנמצא אז רק במצב לא פעיל.
חומרים מעכבים אלה כוללים, למשל, W-7. בנוסף, חלק מתרופות הפנוטיאזין הפסיכוטרופיות מעכבות קלמודולין. לא פחות מפונקציות הרגולציה של קלמודולין, כל כך מגוונים הם הפגמים וההפרעות שאפשר להעלות על הדעת כאשר כבר לא ניתן להפעיל את החלבון על ידי הסידן הקופקטוריור ואנזימי היעד המווסתים עצמם פחות פעילים. הפעלה לא מספקת של ה- CAMKII, למשל, יכולה להביא למגבלה של הפלסטיות העצבית, המהווה את הבסיס לתהליכי למידה.
ירידה בהפעלה של ה- MLCK פוגעת בהתכווצות השרירים, מה שעלול להוביל להפרעות בתנועה. פחות הפעלה של האנזים קלצינאורין כתוצאה ממחסור בקלמודולין הייתה משפיעה על התגובה החיסונית של הגוף ופחות הפעלה של ה- eNOs תוביל לריכוזי NO נמוכים יותר. האחרון גורם בעיקר לבעיות בהן אחרת תחמוצת החנקן אמורה למנוע קרישת דם לא רצויה ולהרחיב את הכלים לצורך זרימת דם טובה יותר. עם זאת, יש להזכיר גם בנקודה זו כי חיישן הסידן Frequenin יכול להשתלט על הפונקציות הביולוגיות של קלמודולין בתנאים מסוימים ובכך להחליף את המולקולה.







.jpg)



.jpg)



.jpg)